Umsetzung der MDR im Dentallabor und in der Zahnarztpraxis
Die Medical Device Regulation trat nach einjähriger Übergangszeit am 26. Mai 2021 vollends in Kraft. Die bis dahin geltenden Richtlinien Medical Device Directive und Active Implantable Medical Devices wurden abgelöst. Auch Monate später gibt es noch Klärungsbedarf: Wer muss was wie umsetzen?
Inhalte
I Umsetzung der MDR
II Herausforderungen seit der Einführung
III Lösungsansatz
IV Weiterführende Informationen
I Umsetzung der MDR
1. Wer muss die MDR umsetzen?
Die Pflicht zur Umsetzung der Medical Device Regulation (MDR 2017 | 745) liegt zum größten Teil bei der Industrie, also den Herstellern von Medizinprodukten wie beispielsweise Dental- oder Praxislaboren. Da Zahnersatz, Schienen und kieferorthopädische Geräte als Sonderanfertigungen gelten, zählen Labore als Sonderhersteller. Aber auch Zahnarztpraxen sind als Anwender davon betroffen.

Die MDR betrifft sowohl Praxis- und Dentallabore als auch Zahnarztpraxen. (c) Talaj, shutterstock.com
Während Zahnarztpraxen bereits seit 2016 ein Qualitätsmanagement vorweisen müssen, lag es bislang im Ermessen des Laborinhabers, ob er ein Qualitätsmanagement betreibt oder nicht. Mit der MDR werden ab dem 26. Mai 2021 bundeslandunabhängig auch Praxis- und Dentallabore verpflichtet, ein Qualitätsmanagement nachzuweisen.
Qualitätsmanagement ist dabei ein Oberbegriff, der u. a. die Bereiche Arbeits-, Betriebs- und Gerätesicherheit sowie Notfall-, Risiko- und Beschwerdemanagement und Hygiene abdeckt.
1.1 Zahnarztpraxis: Was ändert sich durch die MDR im Qualitätsmanagement?
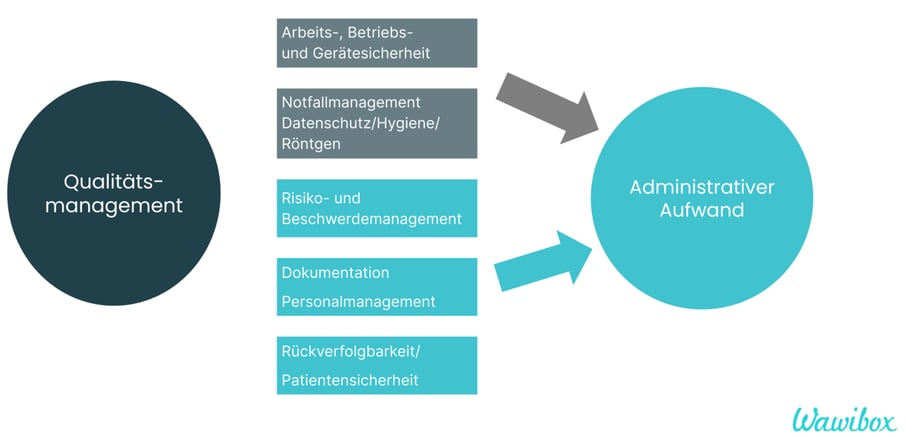
Für Zahnarztpraxen gilt: Von den fünf Kategorien bleiben die oberen beiden weitestgehend unberührt, bei den unteren drei (in der Grafik blau gefärbt) ist jedoch eine Nachsteuerung notwendig.
Was ist also konkret zu tun?
1. Gefahrenstoffverzeichnis muss überarbeitet werden
2. Sicherheitsdatenblätter müssen vervollständigt werden
3. Medizinproduktebuch muss erstellt werden
4. Gebrauchsanweisungen für Materialien und Geräte müssen aufbewahrt werden
5. Mitarbeiteruntersuchungen und Schulungen müssen durchgeführt werden
1.2 Dentallabor: Was ändert sich durch die MDR im Qualitätsmanagement?
Dentallabore stehen vor der großen Herausforderung, diese fünf Kategorien neu zu implementieren:
1. Arbeits-, Betriebs- und Gerätesicherheit
2. Notfallmanagement, Datenschutz/Hygiene/Röntgen
3. Risiko- und Beschwerdemanagement
4. Dokumentation, Personalmanagement
5. Rückverfolgbarkeit/Patientensicherheit
Dabei können jeweils folgende Punkte helfen:

Dentallabore müssen im Rahmen der MDR ein Qualitätsmanagementsystem implementieren | Quelle: Wawibox
Was ist also konkret zu tun?

Weitere Informationen zum Risikomanagement inkl. Risikoanalyse findest du in der Webinar-Präsentation, die wir dir im Rahmen unseres MDR-Pakets kostenfrei zur Verfügung stellen.
1.3 Wer kontrolliert die Durchführung?
Die Verordnung sieht regelmäßige stichprobenartige Überprüfungen der Dokumentation durch „Benannte Stellen“ vor. Benannte Stellen sind zur Überprüfung und zum Audit berechtigte Einrichtungen (öffentlich oder privatwirtschaftlich).
Zu Strafen liegen uns derzeit noch keine endgültigen Informationen von den Innungen oder Zahnärztekammern vor.
1.4 Welche Materialien dürfen verwendet werden?
Die Praxen sollten nur Materialien verwenden, die die Anforderungen aller gültiger EU-Richtlinien erfüllen. Produkte mit CE-Kennzeichnung dürfen in jedem Mitgliedsstaat der EU betrieben und vermarktet werden. Ausgenommen sind Arzneimittel und Gefahrenstoffe.

(c) Andrey_Popov, shutterstock.com
2. Welche Materialien müssen dokumentiert werden?
Die Implementierung bzw. Überarbeitung eures Qualitätsmanagementsystems ist zwingend notwendig, um im Fall eines Audits durch eine Benannte Stelle auf der sicheren Seite zu stehen. Auch euer Risikomanagementsystem muss gut dokumentiert sein.
Besonders wichtig ist der Aspekt der Rückverfolgbarkeit; ebenso schwierig ist es aber auch, bei diesem Punkt eine klare Aussage zu treffen.
QM-Expertin Carmen Rinker sieht das Thema so: „Alle implantierbaren Medizinprodukte, die mindestens 30 Tage im Mund der Patient:innen bleiben, müssen zurückverfolgt werden können. Dazu zählt beispielsweise auch Material wie Keramikmasse, Primer und Opaker. Und auch KFO-Materialien wie Brackets, Zahnspangen und Retainer – egal ob lose oder festsitzend. Reparaturarbeiten müssen jedoch nicht dokumentiert werden, sondern lediglich Neuanfertigungen.“
Der Gesetzestext besagt an dieser Stelle:
„‘Implantierbares Produkt’ bezeichnet ein Produkt, auch wenn es vollständig oder teilweise resorbiert werden soll, das dazu bestimmt ist, durch einen klinischen Eingriff
—
ganz in den menschlichen Körper eingeführt zu werden oder
—
eine Epitheloberfläche oder die Oberfläche des Auges zu ersetzen
und nach dem Eingriff dort zu verbleiben.
Als implantierbares Produkt gilt auch jedes Produkt, das dazu bestimmt ist, durch einen klinischen Eingriff teilweise in den menschlichen Körper eingeführt zu werden und nach dem Eingriff mindestens 30 Tage dort zu verbleiben.“²![]() Wawibox-Tipp: Wir geben unser Bestes, Licht für dich in die MDR zu bringen – eine rechtsverbindliche Auskunft können wir dir aber leider nicht geben. Bei Unsicherheiten raten wir dir daher zu externer Hilfe in Form einer verbindlichen Rechtsberatung oder durch QM-Expert:innen.
Wawibox-Tipp: Wir geben unser Bestes, Licht für dich in die MDR zu bringen – eine rechtsverbindliche Auskunft können wir dir aber leider nicht geben. Bei Unsicherheiten raten wir dir daher zu externer Hilfe in Form einer verbindlichen Rechtsberatung oder durch QM-Expert:innen.
3. Wie wird die Rückverfolgbarkeit im Tagesgeschäft umgesetzt?
Das theoretische Wissen, was dokumentiert werden muss, nun umzusetzen, ist eine große Herausforderung. Je besser deine Praxis oder dein Labor von Anfang an organisiert sind, desto effizienter geht dir die Arbeit im Alltagsgeschäft von der Hand.
Überlege dir zunächst, ob du beispielsweise die Rückverfolgbarkeit von Chargen bis zu deinen Patient:innen oder nur bis zur Lieferung gewährleistest.
Beide Varianten sind rechtskonform, gehen jedoch mit unterschiedlichem Aufwand einher.
Anforderungen für die Rückverfolgbarkeit...
|
... bis zu deinen Patient:innen: internes Chargenbuch mit folgenden Angaben: |
... bis zur Lieferung internes Chargenbuch mit folgenden Angaben: |
|
|
|
|
|
|
*Grundsätzlich reicht es auch aus, die Chargennummer in eurer Praxissoftware oder Akte zu vermerken, damit liegt die Verantwortung allerdings ausschließlich in eurer Praxis. Wenn ihr sie mit euren Patient:innen teilt, sprecht ihr ihnen zugleich Selbstbestimmung und Selbstkontrolle zu.
![]() Wawibox-Tipp: Deutlich einfacher geht die digitale Dokumentation mit der Wawibox Pro. Drucke dir einfach die Chargenetiketten aus und klebe sie in dein Chargenbuch und ggf. auf die Rechnung für die Patient:innen.
Wawibox-Tipp: Deutlich einfacher geht die digitale Dokumentation mit der Wawibox Pro. Drucke dir einfach die Chargenetiketten aus und klebe sie in dein Chargenbuch und ggf. auf die Rechnung für die Patient:innen.
4. Rückruf: Was ist zu tun?
Im Rahmen eures Qualitätsmanagements solltet ihr eine Verfahrensanweisung erstellen, in der genau geregelt ist, wie ihr bei einem Rückruf vorgeht. Dabei könnt ihr euch von erfahrenen Experten helfen lassen.
Zusätzlich müsst ihr unverzüglich entweder das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder das Paul-Ehrlich-Institut elektronisch benachrichtigen. Beide Institute sind für sämtliche Rückrufe zuständig, es ist also egal, an welches ihr euch wendet.
Die beiden Behörden leiten die Vorkommnis-Meldung an den Hersteller weiter; dieser muss dann darstellen, wleche korrektiven Gegenmaßnahmen getroffen werden.
Auch für die Kommunikation zwischen Praxis und Labor benötigt ihr im Schnittstellenmanagement eures Qualitätsmanagements eine klare Regelung mit Verfahrensanweisung.
5. Anfertigung neuer Arbeiten: Was wird dokumentiert?
Die gute Nachricht zuerst: Entgegen vieler Befürchtungen musst du im Labor nicht jeden einzelnen Schritt bei jeder neuen Arbeit dokumentieren.
Vielmehr musst du einmalig eine Verfahrensanweisung festlegen, wie die Anfertigungen in eurem Labor gemacht werden. Daran sollten sich dann natürlich auch alle halten.
Eine solche Verfahrensanweisung ist tatsächlich für jeden Arbeitsablauf in Praxis und Labor vonnöten. ![]() Wawibox-Tipp: Um diesen Prozess sauber aufzusetzen, empfiehlt es sich, QM-Expert:innen mit ins Boot zu holen. Gerade für kleine Labore ist die erstmalige Implementierung eines QMs oftmals eine immense Herausforderung.
Wawibox-Tipp: Um diesen Prozess sauber aufzusetzen, empfiehlt es sich, QM-Expert:innen mit ins Boot zu holen. Gerade für kleine Labore ist die erstmalige Implementierung eines QMs oftmals eine immense Herausforderung.
6. Was muss in die Konformitätserklärung?
Folgende Daten musst du in der Konformitätserklärung festhalten:
- Hersteller (inkl. aller Adressen, falls es mehrere Standorte gibt)
- Verordnender Arzt
- Pat.-Name oder Pat.-Nummer laut Karteikarte
- Produktbezeichnung (z. B. „Einzelkrone aus Zirkon“)
- Materialien
- Charge
- CE-Kennzeichen
- Der Hinweis, dass das hergestellte Medizinprodukt ausschließlich für den bestimmten Patienten hergestellt ist
.png?width=848&name=Marketing%20-%20Webinar_%20MDR%20Erkenntnisse%20f%C3%BCr%20Teilnehmer%20(4).png)
Die Chargennummer muss übrigens auch bei Fremdanfertigungen mitgeliefert werden.
Die Konformitätserklärung gibst du dem Patienten mit; QM-Expertin Carmen Rinker empfiehlt außerdem, immer auch einen Scan für die Patient:innenakte anzufertigen.
![]() Wawibox-Tipp: Eine Beispiel-Vorlage für die Konformitätserklärung findest du in der Webinar-Präsentation in unserem MDR-Paket.
Wawibox-Tipp: Eine Beispiel-Vorlage für die Konformitätserklärung findest du in der Webinar-Präsentation in unserem MDR-Paket.
7. Zum Hintergrund: Warum gibt es die MDR überhaupt?
Durch die neue EU-Medizinprodukteverordnung sollen Patient:innen durch ein internes Qualitätsmanagement vor fehlerhaften oder risikobehafteten Medizinprodukten geschützt werden.
Ausschlaggebend für die neue Verordnung waren Brustimplantate, die mit Industriesilikon gefüllt waren.¹ Dieser Skandal führte zur Forderung von Experten, Materialien, die im Körper der Patient:innen verbleiben, zu deren Schutz besser zu dokumentieren.
„Zudem sollen europaweit alle medizinischen Wirtschaftsakteure und Gesundheitseinrichtungen miteinbezogen werden, die nun für den gesamten Lebenszyklus eines Medizinprodukts verantwortlich sind. Hierbei heißt es deutlich, jeder der am Wertschöpfungsprozess beteiligt ist, ist für die vor- und nachfolgende Stufe (mit-)verantwortlich“¹, so die DZW.
II Herausforderungen seit der Einführung
8. Widersprüchliche Aussagen / unklare Gesetzeslage
Auch Monate nach der Einführung sind einige widersprüchliche Aussagen im Umlauf, beispielsweise was die Rückverfolgbarkeit von Materialien betrifft. Wir haben gemerkt: Je nachdem, wo wir nachfragen, erhalten wir andere Auskünfte. Und so empfiehlt Carmen Rinker, dass du dich am besten an deine KZV hältst.
Tipp für KFO: Wenn Unklarheiten bestehen, kannst du dich an den Dachverband wenden.
9. Fehlende Vernetzung der bestehenden Systeme
Da in einer Praxis meist unterschiedliche Systeme genutzt werden (z. B. eine Materialverwaltung, Patientenverwaltung, Bestellsysteme, und dann noch verschiedene Systeme von externen Partnern), ist es leider derzeit noch schwierig, Schnittstellen zu entwickeln, die all die individuellen Systeme und Anforderungen abdecken können.
Zudem basieren gerade viele Praxisverwaltungssysteme noch nicht auf modernen Technologien und bieten daher auch noch nicht das Potenzial, mit anderen Programmen verbunden zu werden.
Zwar gibt es mit QR-Codes eine einfach Übermittlungsmöglichkeit; da hier jedoch noch keine allgemeinverbindlichen Standards eingehalten werden, bieten auch QR-Codes noch keine verlässliche Informationsübertragung.
10. Unsicherheit der Mitarbeiter:innen / Fehlende Weiterbildung
Da die Umsetzungen komplex und Aussagen schwammig sind, zugleich aber eine Menge Veränderungen bedeuten, kann es durchauss Sinn für dein Team ergeben, eine externe Kraft mit ins Boot zu holen. Praxisberater:innen können mit dem Team eine Bestandsaufnahme machen, Lösungen erarbeiten und auch helfen, alle Maßnahmen in einem Teammeeting vorzustellen. Auch ohne externe Hilfe empfehlen wir dir, sämtliche Mitarbeiter:innen zusammenzutrommeln, damit alle das gleiche Verständnis für die Neuerungen entwickeln und sich ggf. gegenseitig daran erinnern können.
Solche Prozessveränderungen sind keineswegs zu unterschätzen; es braucht Gewöhnung und Zeit zum lernen, darum ist es hilfreich, immer mal wieder gemeinsame Statuschecks durchzuführen: Wie läuft's aktuell? Gibt es neue Fragen?
Ein weiterer Tipp von uns: Sorge dafür, dass dein Team die passenden Rahmenbedingungen erhält: Mit einem "das müsst ihr jetzt einfach noch on top machen" wird es nicht funktionieren. Überlegt stattdessen gemeinsam: Braucht dein Personal vielleicht 5 Minuten mehr Luft nach einer Behandlung für die Dokumentation? Braucht ihr einen zusätzlichen Computer, weil es einfach viel mehr Dinge zu dokumentieren gibt? Braucht ihr nochmal eine Schulung, ein Webinar, externe Hilfe?
III Lösungsansatz
11. Geht die Rückverfolgung auch mit wenig Aufwand? Ja – mit Wawibox Pro
Die Wawibox Pro ist eine Online-Materialverwaltung, die eure Bestände durch einfaches Ein- und Ausscannen in Echtzeit erfasst und somit Transparenz und Kontrolle in euer Lager bringt.
Dank druckbarer Chargenetiketten erledigt ihr die MDR-Dokumentationspflicht ganz entspannt und modern mit wenigen Klicks. Pro Produkt lassen sich übrigens beliebig viele Chargenetiketten drucken. So muss die Charge auch bei Produkten, die häufiger in Verwendung sind, nicht jedes Mal manuell notiert werden – eine Fehlerquelle und Arbeitslast weniger.
.png?width=869&name=Marketing%20-%20Webinar_%20MDR%20Erkenntnisse%20f%C3%BCr%20Teilnehmer%20(5).png)
Auch Sicherheitsdatenblätter kannst du mit einem Klick abspeichern und von all euren Geräten abrufen.
Wir zeigen dir die Wawibox Pro gerne in einer unverbindlichen Produktdemo, in der wir all deine individuellen Fragen klären.
IV Weiterführende Informationen
MDR-Paket von Wawibox inkl. Webinar-Aufnahme
BVMed: Dokument zur Implementierung der MDR
BVMed: Broschüre zum Medizinprodukterecht
BVMed: Handlungsempfehlungen zur Implementierung der MDR
Qualitätsmanagement Carmen Rinker:
Quellen
¹ https://www.dzw.de/sites/default/files/2021-04/MDR-Soforthilfe.pdf
² https://lexparency.de/eu/MDR/ART_2/




